CheckMate-012 的1b 期研究最新结果显示在一线晚期非小细胞肺癌患者的延长随访中观
察到Nivolumab 与Ipilimumab 联合治疗达到令人鼓舞的生存结果

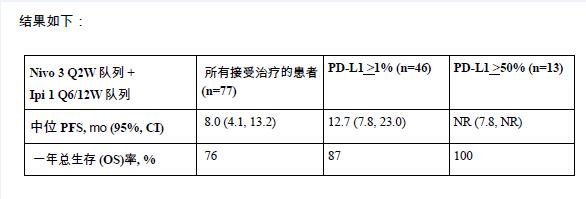
1.(2016年12月5日,美国新泽西州普林斯顿)- 百时美施贵宝公司(纽约证交所代码:BMY)发布了一项名为CheckMate-012的1b期最新临床研究结果,该研究旨在评估在不同剂量、不同方案中,Nivolumab单药或者与Ipilimumab联合治疗未经化疗的晚期非小细胞肺癌患者的治疗效果。该临床研究的数据此前已作过报道。此次更新了中位随访16个月的最新结果,包括了两个Nivolumab和Ipilimumab联合用药队列的疗效汇总分析[Nivolumab剂量3mg/kg,每2周一次;Ipilimumab剂量1mg/kg,每6周一次(Q6W)或每12周一次(Q12W)]。在联合用药队列中,PD-L1表达率≥1%的患者(n=46例)中位无进展生存期为12.7个月(95% CI: 7.8, 23.0),PD-L1表达率≥50%的患者(n=13例;95% CI: 7.8, NR)尚未观测到中位无进展生存期。对于PD-L1表达率≥50%的患者(n=13例),联合用药队列的一年总生存率为100%。此外,所有接受治疗的患者(n=77例)经证实的客观缓解率为43%,接近Nivolumab单药治疗组(23%;n=52例)的2倍,有6例患者(8%)达到完全缓解,其中3例患者的PD-L1表达率<1%。Q12W和Q6W联合治疗队列的3/4级治疗相关不良事件发生率分别为42%和31%。
2.美国康涅狄格州纽黑文市耶鲁癌症中心医学副教授Scott N Gettinger医学博士指出,“在CheckMate-012临床研究的延长随访期中,我们观察到Nivolumab与Ipilimumab联合用药得到了令人鼓舞的无进展生存期结果。我们也欣喜地看到,无论是PD-L1表达还是非表达患者,其缓解率都接近Nivolumab单药治疗的2倍,而此前曾报告过,PD-L1表达率不低于1%和50%的患者,其缓解率分别超过50%和90%。我们非常期待在一线治疗晚期肺癌中进一步对Nivolumab与Ipilimumab联合用药进行评估。”
来自CheckMate-012研究的结果于5日欧洲中部时间上午11点在奥地利维也纳举办的国际肺癌研究协会第17届世界肺癌大会(WCLC)一场口头报告中公布。
百时美施贵宝公司肺癌药物研发部主管Nick Botwood医学博士表示:“CheckMate-012研究的最新结果不断传来好消息。我们非常期待在研究一线治疗晚期肺癌患者的CheckMate-227三期临床试验中,能够进一步评估Nivolumab与Ipilimumab联合治疗的效果,进一步确认这些结果。”

3.关于CheckMate-012研究
CheckMate-012是一项多臂1b期临床研究,旨在评估在不同剂量、不同方案中,Nivolumab单药,或者与Ipilimumab联合治疗未经化疗的晚期非小细胞肺癌患者中的安全性和耐受性(主要终点)。该研究的次要终点为客观缓解率(ORR)以及24周的无进展生存率(PFS)。探索性终点为不同PD-L1表达率患者的总生存期(OS)和疗效。
在世界肺癌大会上更新了两个联合治疗近16个月的中期随访结果,-Nivolumab 3 mg/kg,每2周给药一次;Ipilimumab 1 mg/kg,每6周给药一次(Q6W)(n=39例)或每12周给药一次(Q12W)(n=38例)。该研究同时纳入了PD-L1表达( >1%)和非表达者(<1%)的患者。各队列中基线PD-L1表达可定量患者中,大多数为PD-L1表达>1%的患者,在Q6W和Q12W队列中分别占72%和70%。
联合用药队列中,所有接受治疗的患者和不同PD-L1表达水平的患者,其PFS和OS结果如下:
在世界肺癌大会上同时报告了Q6W队列和Q12W队列中PD-L1表达率≥1%患者的其它治疗效果情况,总结如下:

Nivolumab与Ipilimumab联合治疗的治疗相关不良事件(AEs)发生率和既往报告结果相似。Q12W和Q6W联合治疗队列的任何级别治疗相关AEs发生率分别为84%和74%,3/4级AEs发生率分别为42%和31%。在Q12W和Q6W联合治疗队列中有18%的患者因任何级别治疗相关AEs停止研究治疗,有8%的患者因3/4级治疗相关AEs停止研究治疗。

4.关于肺癌
据世界卫生组织报告,肺癌是全球癌症死亡的首要原因,每年导致超过150万人死亡。非小细胞肺癌(NSCLC)是肺癌中最常见的类型,约占所有肺癌病例的85%。在所有肺癌病例中,鳞状细胞癌约占25%-30%,非鳞状非小细胞癌约占50%-65%。肺癌的生存率与诊断时肿瘤的分期及类型高度相关。在全球,I期NSCLC的5年生存率在47%-50%之间,而IV期NSCLC的5年生存率仅有2%。
5.关于Nivolumab
Nivolumab是一种PD-1免疫检查点抑制剂,独特地利用人体自身的免疫系统来帮助机体恢复抗肿瘤免疫反应。这种通过利用人体自身免疫系统来抗击癌症的特性,使Nivolumab已成为多种肿瘤类型的重要治疗选择。
基于百时美施贵宝在I-O治疗领域的科学专长,Nivolumab拥有全球领先的研发项目,涵盖多种肿瘤类型的各期临床试验,包括III期临床试验在内。截至目前,Nivolumab的临床研发项目已有超过25000名患者入组。Nivolumab的临床试验有助于加深理解生物标志物对患者治疗的潜在作用,特别是识别不同PD-L1表达水平的患者如何能够从Nivolumab中获益。
2014年7月,Nivolumab成为全球首个获得监管机构批准的PD-1免疫检查点抑制剂,目前Nivolumab已在超过57个地区获得批准,包括美国、欧盟和日本。2015年10月, Nivolumab与Ipilimumab联合治疗黑色素瘤成为首个获得监管机构批准的免疫肿瘤药物联合疗法,目前已在超过47个地区获得批准,包括美国和欧盟。
美国食品药品监督管理局(FDA)批准的NIVOLUMAB®适应证
NIVOLUMAB®(nivolumab)单药疗法可用于治疗BRAF V600突变阳性不可切除性或转移性黑色素瘤。基于NIVOLUMAB在无进展生存期上的显著效果,该适应证获得了快速批准。根据确证性试验的临床获益结果,可判断该适应证的继续批准情况。
NIVOLUMAB®(nivolumab)单药疗法可用于治疗BRAF V600野生型不可切除性或转移性黑色素瘤。
NIVOLUMAB®(nivolumab)联合IPILIMUMAB®(ipilimumab)适用于不可切除性或转移性黑色素瘤患者的治疗。基于该疗法在无进展生存期上的显著效果,该适应证获得了快速批准。将根据确证性试验的临床获益结果,判断该适应证的继续批准情况。
NIVOLUMAB®(nivolumab)可用于含铂化疗方案治疗中或治疗后进展的转移性非小细胞肺癌(NSCLC)的治疗。对于EGFR突变或ALK重排的患者,在使用NIVOLUMAB前,应确认患者已经使用过FDA批准的针对这些基因异常的治疗药物而出现了疾病进展。
NIVOLUMAB®(nivolumab)可用于曾使用抗血管生成药物的晚期肾细胞癌(RCC)患者的治疗。
NIVOLUMAB®(nivolumab)可用于自体造血干细胞移植(HSCT)及移植后,用brentuximab vedotin治疗复发或病情有进展的经典型霍奇金淋巴瘤(cHL)。基于该药在总缓解率上的显著效果,该适应证获得了快速批准。将根据确证性试验的临床获益结果,判断该适应证的继续批准情况。
NIVOLUMAB®(nivolumab)可用于含铂化疗期间或化疗后进展的复发或转移性头颈部鳞癌(SCCHN)患者的治疗。
6.关于百时美施贵宝和小野制药株式会社的合作
2011年,百时美施贵宝与小野制药株式会社(Ono)签署合作协议,获得在全球(除日本、韩国和台湾之外)开发和上市Nivolumab的特许权,小野制药当时保留了对该化合物的所有权。2014年7月23日,百时美施贵宝与小野制药就多个免疫药物共同开发和商业化再次签署战略合作协议,包括单药治疗和联合疗法,以帮助解决日本、韩国和台湾癌症患者的需求。
7.百时美施贵宝前瞻性声明
本篇新闻稿含有关于药品研究、开发和商业化的“前瞻性声明”,该声明系1995年私人证券诉讼改革法案的规定作出。该声明基于现时的期望作出,包含已知或未知风险的声明描述,包括可能导致推迟、转移或更改的因素,以及可能导致实际结果严重偏离现时期望的因素描述。任何前瞻性声明均无法保证。在其它风险中,无法保证Nivolumab或Nivolumab与Ipilimumab联合治疗将获得新增适应证的监管批准。对本篇新闻稿的前瞻性声明应与很多其它可能影响百时美施贵宝业务的不确定性共同进行评估,尤其是百时美施贵宝截止2015年12月31日年报表10-K、季度报告表10-Q和现时报告表8-K中警告事项中描述的不确定性。无论是否出现新信息、新事件或其它事件,百时美施贵宝不承担公开更新此前瞻性声明的任何义务。
(Nivolumab和Ipilimumab尚未在中国上市)